福医美国校友会(AAFMUA)大查房:今日的预防接种,明天的健康保证(1)
美国宾州Mount Nittany医学中心家庭全科/医院医生 林艳丰;福建省龙岩市第一医院肿瘤中心 倪晓雷

陈燕惠医生:
大家好,AAFMUA大查房之“今日的预防接种,明天的健康保证”即将开始,我是福建医科大学附属协和医院儿科陈燕惠医生,很高兴有机会担任此次大查房的主持,和我一同主持的医生还有:
· 郭伟医生:美国家庭医生,美中诺博私人医生集团创始人;
· 吴晓枫医生:新加坡卫生科学局。
主讲医生简介及其话题:
· 吴晓枫医生:新加坡卫生科学局。“疫苗的批准和疫苗的标签说明(Vaccine Approval Process and Vaccine Label)”
· 马秋华医生:澳大利亚马格尔医疗中心/肯辛顿医疗中心全科/小儿科。“有关预防接种的常见传说和误区(Common Immunization Myths and Misconceptions: Talking Points and Resources for Busy Healthcare Professionals )
· 林月珍医生:美国贝勒医学院(Baylor College of Medicine)儿科系助理教授、得克萨斯儿童医院(Texas Children’s Hospital)儿科内分泌医师。“怎样与对接种疫苗感到犹豫的家长交谈(a new model for talking to parents about vaccines)”
· 谢党赐医生:美国凯撒(Kaiser)北加州医疗系统家庭医生。“美国的疫苗管理委员会(Advisory committee immunization practices)和疫苗安全的监管”
· 郭伟医生:美国新奥尔良家庭医生。“疫苗接种后的免疫力检测和再接种计划(immunity check and re vaccination)”
· 许旭东医生:美国休斯顿家庭医生。“疫苗接种时易患的错误及其预防(Vaccination error and how to prevent them)”
· 王正义医生:美国俄亥俄河谷医学中心儿科医生。“疫苗免疫的风险性,什么是无效疫苗和‘毒性’疫苗,它们之间的关系是什么?”
· 林艳丰医生:美国宾州Mount Nittany医学中心医院医生。“全球疫苗安全和世界免疫周”
郭伟医生:
通过这次大查房我们希望大家可以一起复习有关预防接种的基础知识,一起提高有关疫苗接种中可能遇到的一些常见的问题和解答,共同认识预防接种的重要性。希望大家一起在日常工作中推广预防接种常识,辅导民众对疫苗使用的担心与恐慌,重新树立预防保健接种的信心,来提高和保障社会居民的健康。
我们知道疫苗在预防许多传染病中起到了关键作用。中国从实施儿童计划免疫以来,许多传染病的发病率显着下降。
近些年来,随着社会的发展,流动人口不断增加,加上大部分流动人口往往来自农村、边远山区等经济条件较差的地区,疫苗接种率较低,也没有隐性感染,一旦接触病原体,多数缺乏免疫力,极易引起传染病的流行和暴发。所以在大力推广儿童免疫计划的同时,我们也应该注意到成人的免疫。对疫苗可预防的疾病,每个成年人也应得到适当保护,予以相应的免疫接种。
特别是随着社会经济的发展以及医疗健康技术水平的提高,人们的寿命也在增长,现代社会中除了注意少年儿童的医疗保健的同时,我们知道另一个群体正在逐渐地壮大,那就是老年人。所以我们也应该提倡老年人的医疗保健和老年人的预防接种,比如说流感疫苗、肺炎疫苗、带状疱疹疫苗等。
疫苗的合理使用不仅可以减少许多传染病,同时还可以大大地提高人们的生活质量。
首先我们先请吴晓枫医生分享“疫苗的批准和疫苗标签说明” (Vaccine Approval Process and Vaccine Label)
吴晓枫医生:


国家药监机构遵照本国法规批准并监管疫苗的质量、安全性、有效性。例如美国FDA、澳大利亚TGA、日本PMDA、新加坡HSA (卫生科学局)。

赞助商要注册疫苗,必须呈上疫苗生产文件,数据,非临床和临床试验报吿给国家药监机构。这些卷宗用于评估该疫苗。这些卷宗的阐述包括:
– 疫苗的物化,生产方法, 流程,测试方法和测试结果,貭量控制,直到疫苗签发;
– 疫苗非临床(动物模型)安全性和其引发的保护性免疫反应的能力;
– 疫苗临床(人体试验)的安全性和有效性。

疫苗的临床试验分三个阶段:(1)初始的安全性和免疫保护反应能力研究;(2) 剂量范围探索研究;(3) 有效性和重要的安全数据收集。类似任何化学药物和生物药物。

评估后如果数据表明疫苗的物化、生产、质量控制,其安全性和疫苗的免疫保护一定年龄人群预防感染符合要求,疫苗就会得到批准注册。同时生产疫苗的药厂经过GMP的详细进展检查。
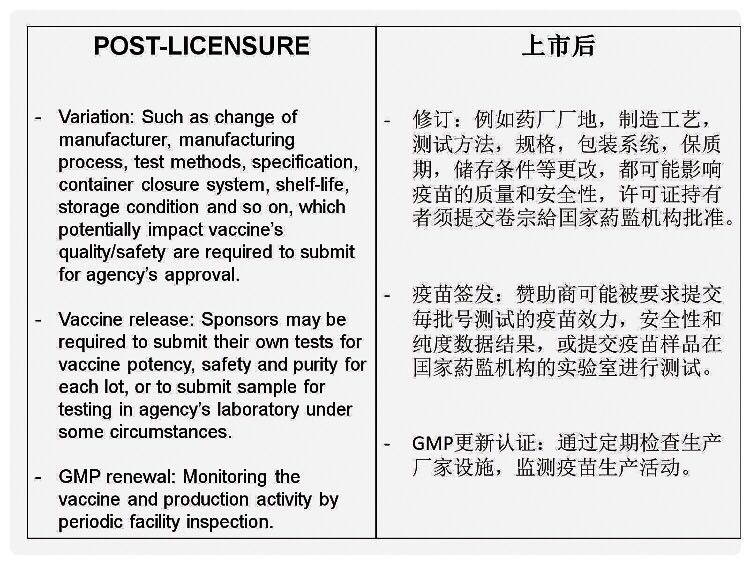
疫苗上市后,审批疫苗修订仍继续,例如药厂厂地、制造工艺、测试方法、规格、包装系统、保质期、储存条件等更改。赞助商可能被要求提交毎批号疫苗效力,安全性和纯度数据,或提交疫苗样品在国家药监机构的实验室进行测试。监管机构通过定期检查药厂厂地设施,监测疫苗生产活动。以便更新GMP认证。
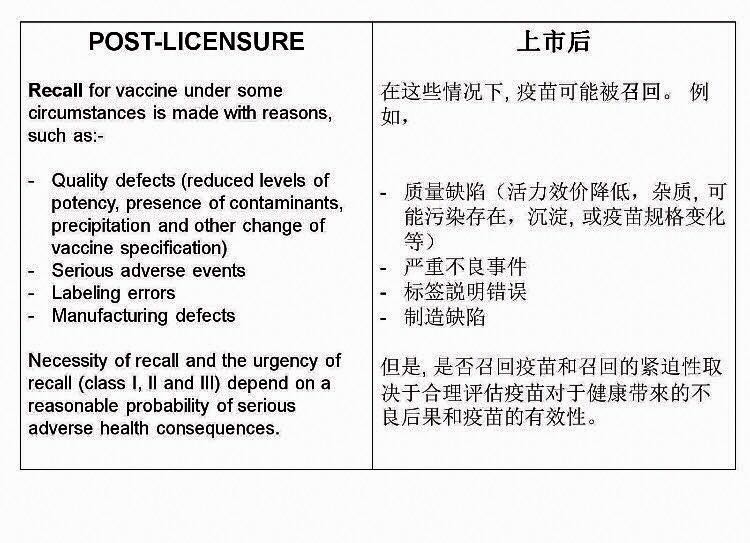
疫苗上市后,在某些情况下,当疫苗对于健康带来不良后果或疫苗质量不符合要求,疫苗可能被召回。例如,
– 质量缺陷(活力效价降低,杂质, 可能污染存在,沉淀, 或疫苗规格变化)
– 严重不良事件
– 标签说明错误
– 制造缺陷

由于疫苗上市前的临床试验只在少数几千人身上测试。所有潜在的罕见不良事件无法预料或发现,直到疫苗被提供给普通人群,因此,疫苗上市后,仍可能进行第四阶段正式试验, 例如:
– 收集重要的安全性数据和抗体持久有效性的数据
– 收集补量带来持久的免疫力数据
– 改接种方案的研究
– 桥接研究以支持疫苗接种不同的年龄组

疫苗上市后,监管机构依赖于疫苗不良事件报告系统发现问题。
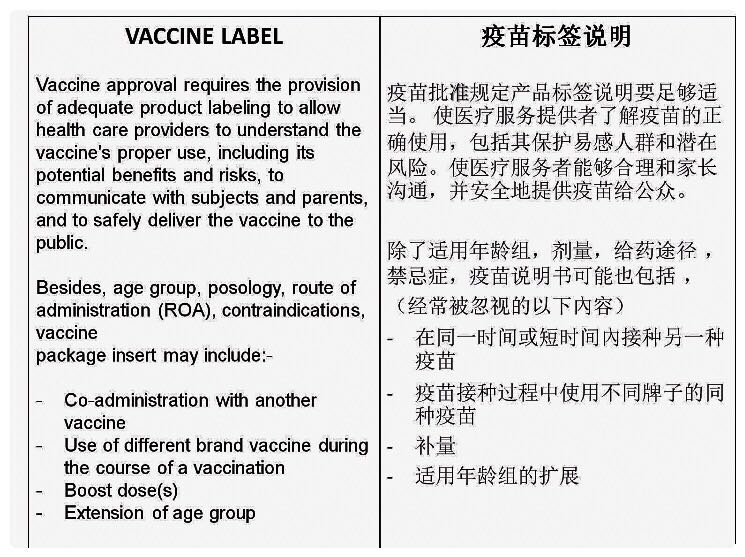
疫苗标签说明除了阐述适用年龄组、剂量、给药途径、禁忌证,也可能包括:
– 在同一时间或短时间内接种另一种疫苗是否安全有效
– 疫苗接种过程中使用不同牌子的同种疫苗是否安全有效
– 补量是否带来持久的免疫力
– 适用年龄组是否扩展
疫苗批准要求产品内容说明要充足,适当。使医疗服务提供者了解疫苗的正确使用,包括其适用年龄组、保护易感人群和接种潜在的风险;使医疗服务者能够合理跟被接种者和家长沟通,并安全地提供疫苗给公众。

疫苗主包装说明除了给药年龄、剂量、途径,标签也包括稀释后使用时间,存放条件,使用其间正确储存和过期丢弃。

疫苗次包装除了给药年龄、剂量、途径,标签也包括有效期、批号、药厂厂地等重要信息。指导疫苗正确使用,储存,有效期和保证疫苗可追溯性。
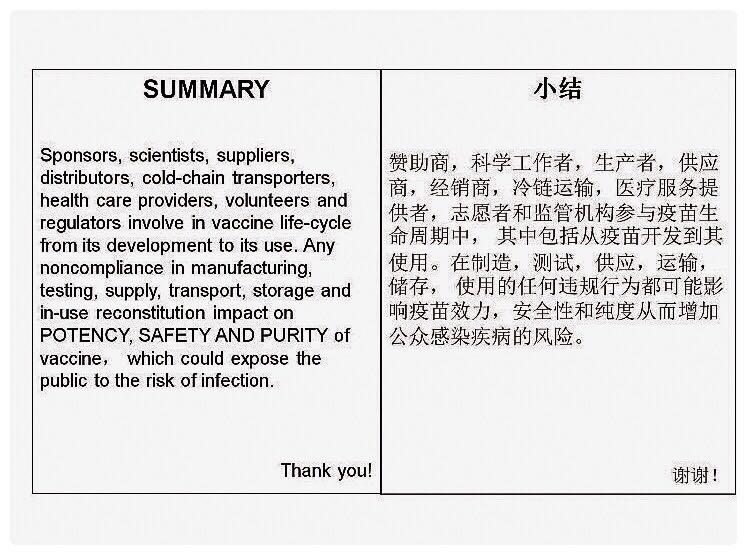
小结:赞助商、科学工作者、生产者、供应商、经销商、冷链运输、医疗服务提供者、志愿者和监管机构参与疫苗生命周期中,其中包括从疫苗开发到其使用。在制造、测试、供应、运输、储存、使用的任何违规行为都可能影响疫苗效力、安全性和纯度从而增加公众感染疾病的风险。
原文:壹生 -福医美国校友会(AAFMUA)大查房:今日的预防接种,明天的健康保证(1)

